制氨气的化学方程式,制氨气的化学方程式研磨

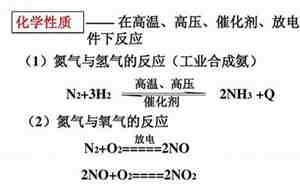
制备氨气(NH3)的常见方法是通过氯化铵(NH4Cl)与氢氧化钙(Ca(OH)2)的反应,这个过程也被称为哈伯-博世法,属于固体与固体之间的复分解反应。以下是制氨气的化学方程式:
\[ \text{Ca(OH)}_2 + 2\text{NH}_4\text{Cl} \rightarrow \text{CaCl}_2 + 2\text{NH}_3 \uparrow + 2\text{H}_2\text{O} \]
在这个反应中,氢氧化钙与氯化铵反应生成氯化钙、氨气和水。氨气是一种无色、有刺激性气味的气体,常用于肥料、制冷剂和氨燃料电池等领域。
实验室操作氨气时需要严格遵守安全规定,因为它是一种碱性气体,接触皮肤或眼睛会引起刺激。在通风良好的环境下操作,并确保佩戴适当的防护设备。
制氨气的化学方程式固液不加热
制氨气不涉及加热的固液反应通常是指哈伯-博世法的改良过程,其中使用的是固态的碱性物质与固态的铵盐,在室温和常压下发生反应。使用的是硝酸钙(Ca(NO3)2)或氢氧化钙(Ca(OH)2)与氯化铵(NH4Cl),在一定条件下反应:
\[ \text{Ca(OH)}_2 + 2\text{NH}_4\text{Cl} \rightarrow \text{CaCl}_2 + 2\text{NH}_3 \uparrow + 2\text{H}_2\text{O} \]
\[ \text{Ca(NO}_3)_2 + 2\text{NH}_4\text{Cl} \rightarrow \text{CaCl}_2 + 2\text{NH}_4\text{NO}_3 \]
这两种反应都不会涉及加热,因为反应的驱动力通常是氨气的挥发性和盐的水合作用。不过,这些反应在现实中的速率可能会比较慢,且产气量有限,主要用于教学演示或实验室规模制备。操作时同样要注意安全防护。
热门推荐
热门标签
热门精选
- 07-04九紫(九紫是什么意思)
- 06-25塔罗牌恶魔正位(塔罗牌恶魔正位代表什么)
- 10-02副旬星(副旬入命宫是什么意思)
- 10-13属龙人运势2025(2025属龙人的全年运势如何)
- 06-17八字算命无金(八字没有金代表什么)
- 10-12正月初五禁忌(正月初五忌讳有什么)
- 06-22潘昭佑讲八字(潘昭佑八字理论之)
- 06-23紫薇星下凡(紫微星为什么老是下凡)